当前,宫颈癌筛查已进入核酸检测时代,HPV检测是初筛首选手段。目前主流检测方法包括HPV DNA检测和HPV mRNA检测,两者究竟有何不同?哪种更能精准识别高风险人群? mRNA检测是否也需要“分型”?今天,我们就来深入探讨HPV检测从“有没有感染”到“会不会致癌”的进阶之路。
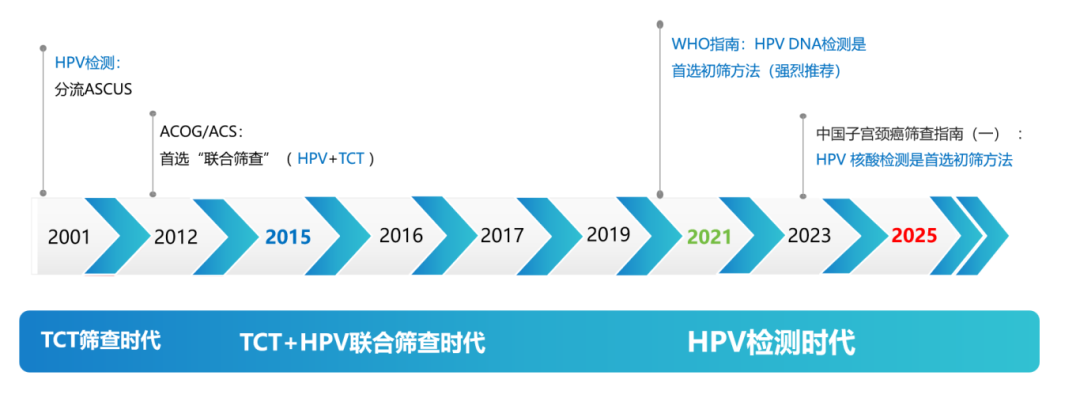
HPV检测发展的关键历程
传统HPV DNA检测,核心是识别“病毒是否存在”。但它有一个明显的短板:无法通过一次检测来区分“一过性感染”和“持续性感染”,检出病毒DNA,并不能提示宫颈病变风险。
真正的危险信号来自E6/E7致癌基因的持续活跃表达——当HPV病毒整合入人体基因组后,E6/E7 mRNA会大量转录,驱动宫颈上皮细胞发生恶性转化[1]。因此,E6/E7 mRNA更像是宫颈病变的“分子开关”,其阳性意味着致癌机制已经启动。

近年来,多项指南共识已明确推荐HPV mRNA检测用于宫颈癌初筛。其优势在于特异性更高,能有效减少对一过性感染的过度诊疗,更聚焦于真正存在病变风险的人群。除一线筛查之外,mRNA检测在ASCUS/LSIL分流、HPV阳性人群管理、辅助活检决策以及术后随访监测中,均展现出精准的临床价值。

本土数据警示:
HPV高危型别存在地域差异
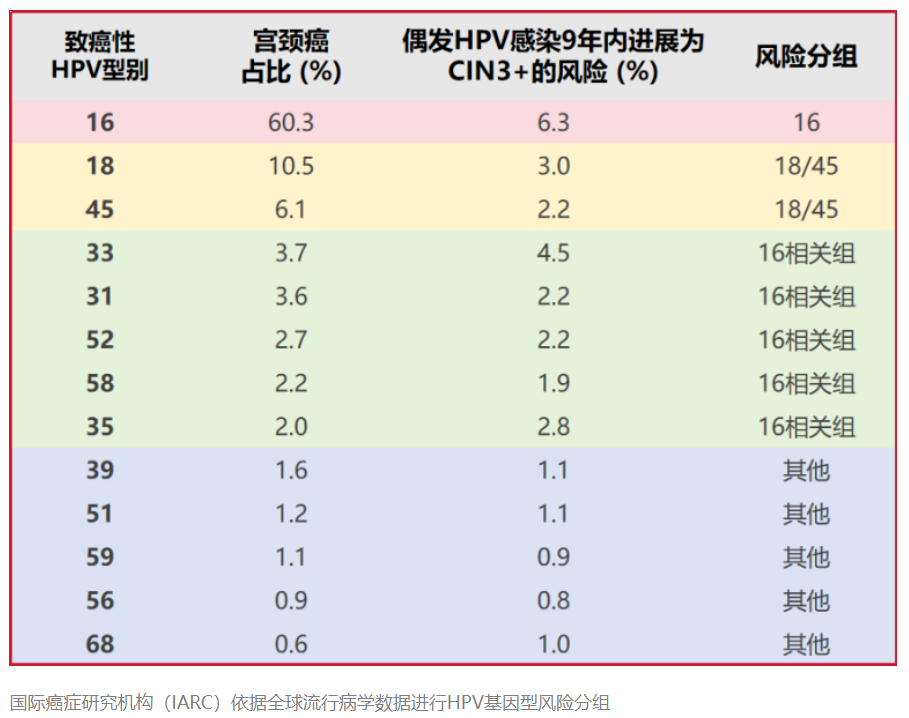
2024年8月《柳叶刀》的一项重磅研究揭示[2]:不同高危HPV型别的致癌潜力不同,且各地域间存在流行差异。例如,全球61.7%的宫颈癌归因于HPV16型,而中国地区HPV58/52型的致癌贡献度显著高于全球水平。该研究建议将个体HPV基因分型纳入筛查体系,通过识别高危型别实现风险分层管理。这意味着,全分型检测,可以更精准地绘制本土化的风险图谱。
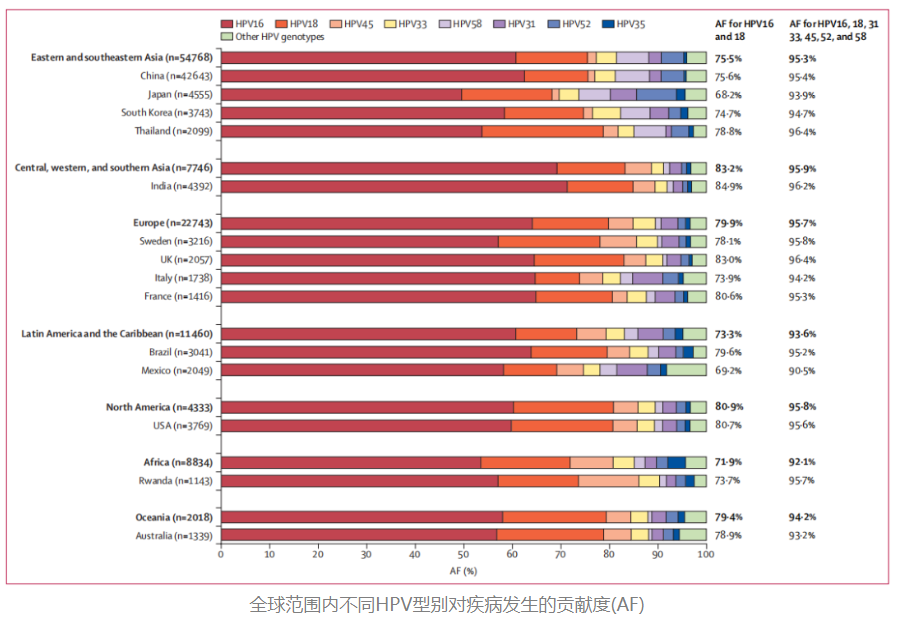
大规模研究进一步证实,在HPV 16/18之后,HPV 31、33、58、52等型别与国内人群高级别鳞状上皮内病变(HSIL)的风险升高最为相关,对特定型别的识别,能显著提升对细胞学正常/轻度异常人群的CIN2+病变预测准确性[3]。这也说明非16/18型别的分型检测在我国具有特殊的重要性——如果不进行分型,或只区分16/18型,我们将错过大量具有本土特色的高风险个体。此外,因全分型可以明确具体的感染型别,有助于鉴别单一或多重感染,能为临床提供更多的诊疗依据,实现更精准的风险管理。
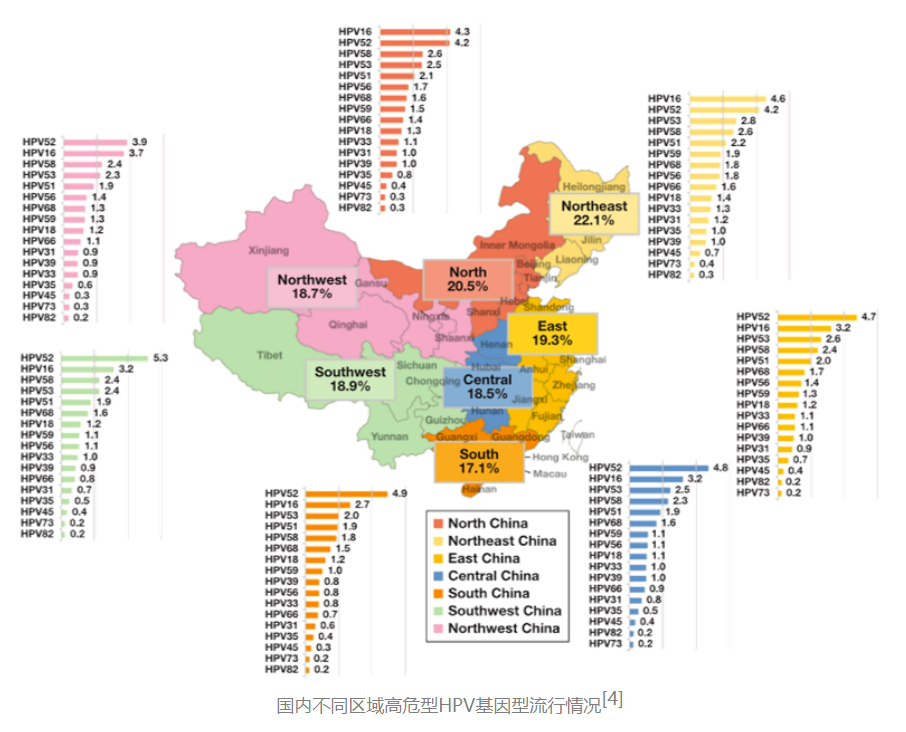
国际指南更新:
推动全分型结果指导精细化管理
2025年1月,持久共识宫颈癌筛查和管理指南委员会基于2019年ASCCP指南,制定了新的HPV拓展分型持久指南[5],强调进一步细化高危型HPV阳性人群的风险分层,优化临床后续决策。
例如:
HPV 16/18阴性,但HPV 31/33/58/35/39/68/45/51/52 阳性者,建议通过双染或细胞学进行分流;
单一HPV 56/59/66阳性且无其他高危型感染者,可考虑1年内随访。

《持久指南》基于不同HPV型别的CIN3+及癌症风险进行高危HPV阳性患者的管理,能够更准确地识别高危人群,实现更精准的风险分层决策。与目前的常规分层策略相比,扩展分型的管理策略在检测CIN2+/CIN3+方面的特异性显著提高,且能更准确地预测宫颈病变及癌症,具有更好成本效益[6]。例如通过检测国内常见的HPV 31/33/58/52型,能识别细胞学正常但中高致癌风险型别的阳性人群,将癌变风险预警窗口前移。
HPV E6/E7 mRNA 14全分型检测,通过同时明确“致癌基因的活跃状态”与“具体的高危型别”,实现了真正意义上的“双重精准”:
确认E6/E7 mRNA是否表达,直接评估致癌活性;
明确具体高危型别,实现个体化风险分层。
这种基于分子机制的“双重”防控策略,正推动宫颈癌筛查从粗放式管理迈向个体化、精细化的新阶段:将宫颈癌筛查的逻辑从“发现病毒感染”升级为“评估个体病变风险”。全分型的E6/E7 mRNA检测,正是这一转变中的关键技术支撑。当mRNA报告提供的不是模糊的“阳性”或“高危”标签,便可为临床医生和每一位女性提供更具针对性、更贴近病变真相的精准防控方案,助力我国加速实现消除宫颈癌的目标。
[1]杨瑶,邹永辉,崔国英等.HPV E6/E7 mRNA 检测在子宫颈病变筛查中应用的初步探讨[J].中华妇产科杂志,2019,54 (12):854-857.
[2]Feixue Wei,et al. Causal attribution of human papillomavirus genotypes to invasive cervical cancer worldwide: a systematic analysis of the global literature[J]. Lancet 2024; 404: 435–44.
[3]Ye Y,Jones TE, Zhao C. Utility of extended HPV genotyping in cervical cancer screening and clinical management.Gynecol Obstet Clin Med 2025;5:e000226.
[4]Nationwide Prevalence and Genotype Distribution of High-Risk Human Papillomavirus Infection in China analysis of 2,458,227 test results From 29 chinese Provinces, Am J Clin Pathol May 2022;157:718-723.
[5]Applying Results of Extended Genotyping to Management of Positive Cervicovaginal Human Papillomavirus Test Results: Enduring Guidelines. J Low Genit Tract Dis. 2025 Jan 10.
[6]Xie H,et al . Diagnostic accuracy of extended HPV DNA genotyping and its application for risk-based cervical cancer screening strategy. Clin Chem Lab Med. 2023 Jul 13;61(12):2229-2236.